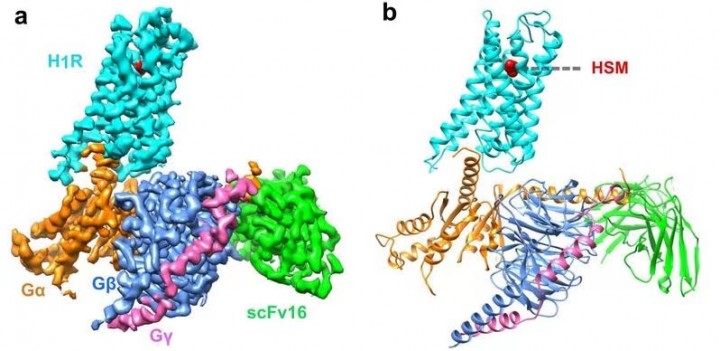
7 апреля исследовательская группа Хэ Юаньчжэн из Центра наук о жизни ХПУ опубликовала статью в журнале Nature Communications, впервые раскрывающую структуру крио-ЭМ комплекса человеческого гистаминового рецептора H1R / Gq. Гистамин – это биологический амин, который оказывает множество физиологических и патологических эффектов, активируя четыре известных рецептора гистамина. Рецепторы гистамина делятся на четыре типа: H1R, H2R, H3R и H4R и принадлежат к суперсемейству рецепторов, связанных с G-белком (GPCR) A-типа. Исследования показали, что H1R и H2R являются мишенями для лечения аллергии и заболеваний, связанных с кислотой желудочного сока, в то время как H3R и H4R имеют большой клинический потенциал при деменции, астме, воспалительном заболевании кишечника и ревматоидном артрите. Рецептор связывается с гистамином, чтобы задействовать гетеротримерный G-белок и запустить сигнальный каскад ниже по течению. H1R в основном связан с белком Gq, чтобы активировать фосфолипазу C, увеличивая уровни инозитолфосфата и внутриклеточного кальция, H2R, связанный с белком Gs, H3R и H4R стимулируют передачу сигнала цАМФ через белок Gi/o.
Гистамин является ключевым медиатором иммунной аллергии (аллергии I типа) и основной причиной аллергических заболеваний, опосредованных H1R. Антигистаминные препараты разрабатываются более полувека, и они всегда были первым выбором для лечения аллергических заболеваний. Антигистаминные препараты первого поколения обладают высокой проницаемостью гематоэнцефалического барьера и низкой селективностью рецепторов, что может вызывать сонливость, сухость во рту и другие побочные эффекты. Антигистаминные препараты второго и третьего поколения могут значительно снизить проницаемость мозга, но все же имеют недостатки, такие как низкое сродство к рецептору и кардиотоксичность. В настоящее время наиболее успешным разработанным антигистаминным препаратом является макромолекула с основной аминогруппой, которая сильно отличается от имидазольного кольца и этиламиновой боковой цепи гистамина, номеханизм блокирования этими макромолекулярными антигистаминными препаратами сигнала H1R остается неясным.
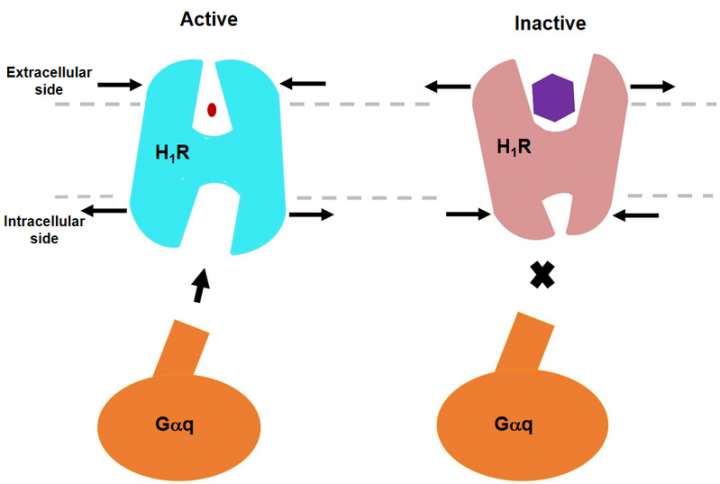
Раннее исследование выявило неактивную структуру связывания H1R с антигистаминными пептидами первого поколения, однако точный механизм, с помощью которого лигандиндуцирует активацию рецептора, до сих пор неясен. Эта статья демонстрирует сложную структуру человеческого белка H1R и Gq с помощью криоэлектронной микроскопии. Эта структура указывает на то, что гистамин активирует рецептор, взаимодействуя с ключевыми остатками трансмембранного домена 3 (TM3) и TM6, сжимая связывающий карман снаружи клетки, открывая полость внутри клетки и рекрутируя белок Gq. Ключевой остаток Y4316.51 TM6 мутирован на положительно заряженный остаток R или K, чтобы заставить его взаимодействовать с ключевым отрицательно заряженным D1073.32 TM3, имитируя эффект гистамина, притягивающего TM6 к TM3 в связывающем кармане, делая рецептор, получает более высокую базовую активность.
Напротив, мы обнаружили, что антигистаминные препараты (обратные агонисты) используют свои большие группы, чтобы раздвинуть TM6 и TM3, расширить карман связывания лиганда и сформировать модель: «активация сжатия, инактивация расширения». Сравнение с другими комплексами рецептор / белок G показывает характеристики связывания Gq, включая взаимодействие между внутриклеточной петлей 2 (ICL2) и белком Gq / 11 αN-β, а также TM7-, который связывается с белком G. Участие спирали 8 (H8). Кроме того, мы также наблюдали, что, когда рецептор задействован, αN белка Gq имеет большое внешнее поступательное движение. Детальный анализ структуры обеспечит основу для понимания селективности связывания G-белка и даст ключ к разгадке дизайна новых антигистаминных препаратов. Это также первый отчет о структуре полноразмерного комплекса Gq.
Ся Жуйсюэ, техник-экспериментатор исследовательской группы Хэ Юаньчжэна, докторанты На Ван и Чжэньмэй Сюй являются соавторами, а магистрант Сун Цзин участвовал в исследовательской работе по этому предмету. Чжан Анци и Го Чанъю, инженеры платформы криоэлектронного микроскопа ХПУ, совместно участвовали в сборе структурных данных. Частично сбор данных проводился при помощи электронного микроскопа. Исследователь Хэ Юаньчжэн является автором-корреспондентом этой статьи.
Ссылка на оригинальный источник:
https://www.nature.com/articles/s41467-021-22427-2#MOESM1