9 июня исследовательская группа профессора Хуан Чживэя из Института наук о жизни и технологий ХПУ опубликовала в Интернете исследовательскую статью под названием «Структурные основы AcrIIA14, ингибирующего Staphylococcus aureus Cas9» в журнале Nucleic Acids Research. В этом исследовании была проанализирована кристаллическая структура с высоким разрешением анти-CRISPR белка AcrIIA14, связанного с Staphylococcus aureus Cas9 (SauCas9). С помощью структурного анализа и соответствующих биохимических экспериментов был объяснен молекулярный механизм белка AcrIIA14, специфически ингибирующего активность расщепления SauCas9. Это исследование расширяет понимание белка анти-CRISPR, регулирующего активность системы CRISPR-Cas, и предоставляет теоретическую основу и новые идеи для точного контроля SauCas9 и других систем CRISPR-Cas для приложений редактирования генов.
Система CRISPR-Cas стала наиболее широко используемым инструментом редактирования генов благодаря удобству использования и очень высокой эффективности редактирования in vivo. Однако остается еще много проблем, которые необходимо решить в практических приложениях. Одной из важных проблем является нецелевой эффект редактирования генов из-за его неконтролируемой сдвигающей активности. Как притормозить систему редактирования генов и контролировать ее редактирующую деятельность всегда было проблемой в той области, которую пытались решить. Система CRISPR-Cas используется в качестве адаптивной иммунной системы бактерий для инвазии фагов. Столкнувшись с селективным давлением бактериального CRISPR-Cas, фаг развил соответствующий антагонистический механизм, то есть фаг развил белок Anti-CRISPR для подавленияактивности системы CRISPR-Cas. В предыдущих исследованиях было обнаружено, что белок AcrIIA14 против Anti-CRISPR может подавлять активность SauCas9, но конкретный молекулярный механизм остается не ясен.
В этом исследовании стабильный AcrIIA14, связывающий четвертичный комплексный белок SauCas9-sgRNA-dsDNA, сначала очищали и собирали внутриклеточно, а затем кристаллическую структуру комплекса анализировали с помощью рентгеновской кристаллографии. Путем анализа структуры комплекса было обнаружено, что белок AcrIIA14 взаимодействует с доменом HNH белка SauCas9 в стехиометрическом соотношении 1: 1. Белок AcrIIA14 связывается с доменом нуклеазы HNH, вызывая конформационные изменения. Это конформационное изменение HNH приводит к тому, что его активный сайт находится далеко от положения, в котором он связывается с ДНК-мишенью, тем самым ингибируя активацию SauCas9. Кроме того, посредством структурного сравнения было также обнаружено, что связывание белка AcrIIA14 индуцирует аллостерический процесс домена HNH и линкера L1 в SauCas9, что приводит к созданию двух новых интерфейсов внутримолекулярного взаимодействия. В сочетании с биохимическими экспериментами было обнаружено, что аллостерический SauCas9, индуцированный AcrIIA14, играет роль в усилении ингибирующего эффекта. Этот эффект, вызывающий аллостерический эффект белка Cas9, отличается от двух других ингибирующих белков AcrIIC1 и AcrIIC3, которые также связываются с доменом HNH, и демонстрирует разнообразие механизма ингибирования SauCas9 белком Anti-CRISPR.
Докторант Лю Хуннань и доцент Чжу Юйвэй из Института наук о жизни и технологий являются первыми авторами данной статьи; Хуан Чживэй является автором-корреспондентом этой исследовательской статьи; магистрант Лу Цзэбинь участвует в части исследовательской работы. Кристаллографические данные этого исследования были собраны в Shanghai Light Source BL17U. Этот проект финансировался Государственным фондом естественных наук Китая.
Ссылка на оригинал статьи: https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab487/6295537
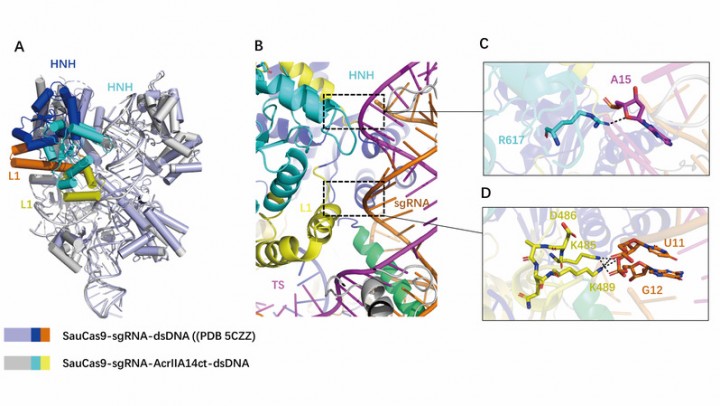
На фото: AcrIIA14 индуцирует аллостерический SauCas9

