23 декабря исследовательская группа Хэ Юаньчжэна из Центра наук о жизни Харбинского политехнического университета опубликовала в международном журнале «Nature Chemical Biology» результаты научных исследований под названием «Структурная основа активации и смещенного агонизма сфингозин-1-фосфатного рецептора 1» (Structural basis of sphingosine 1-phosphate receptor 1 activation and biased agonism). В этой статье сообщается о структурах криоэлектронной микроскопии (крио-ЭМ) комплекса сфингозин-1-фосфатного рецептора 1/Gi (S1PR1/Gi) и раскрывается структурная основа смещенного сигнального пути, продуцируемого эндогенными лигандами и модуляторами лекарственных средств на сфингозин 1-фосфатном рецепторе 1.
Сфингозин-1-фосфат (S1P) представляет собой метаболит сфингомиелина на плазматической мембране клеток, который может регулировать воспалительную реакцию, миграцию клеток, ангиогенез, развитие нейронов и сердца. Нарушенная передача сигналов S1P связано с аутоиммунными, сердечно-сосудистыми и нейродегенеративными заболеваниями и онкологией. S1P в основном выполняет свои физиологические функции с помощью рецепторов S1PRs (S1PR1-5), случайно связанных с Gi-белками. Поскольку сигнал S1P-S1PR1 играет ключевую роль в побуждении лимфоцитов мигрировать из лимфатических органов, S1PR1 является важной мишенью для лечения рассеянного склероза (РС). С точки зрения исследования механизма, в отличие от эндогенного лиганда S1P, модификаторы лекарственных средств — финголимод (FTY720) и синимод (BAF312) — активируют рецептор и связывают смещенный β-аррестином сигнальный путь, индуцируют непрерывную интернализацию S1PR1 в лимфоцитах, в результате чего лимфоциты не могут мигрировать из лимфатических узлов, тем самым замедляя воспаление. Однако конформационные различия смещенной активации S1PR1, вызываемой лекарственными модуляторами, все еще остаются неясными.
Исследовательская группа Хэ Юаньчжэна сначала проанализировала три сложные структуры эндогенного лиганда S1P, модуляторов лекарственных средств FTY720-P и BAF312, соответственно связанных с S1PR1-Gi, с помощью криоэлектронной микроскопии. Структурный анализ и функциональные данные показывают, что три лиганда используют разные механизмы для связывания с рецептором. Среди них S1P и FTY720-P схожи. Их полярные или заряженные остатки расположены над карманом связывания, а гидрофобный хвост расположен ниже кармана гидрофобного связывания; BAF312 связывается с рецептором в основном посредством широкого спектра гидрофобных взаимодействий. По сравнению с неактивной структурой S1PR1, конформационные изменения трансмембранной спирали 6 (TM6) в структуре S1PR1, связанной тремя лигандами, что свидетельствует о конформационных изменениях рецептора после его активации, тем самым формируя сайт связывания Gαi.
Сравнивая структуру антагонистического состояния с структуру активированного, можно обнаружить, что положение и направление W2696.48 в кармане связывания лиганда изменяются больше всего. В кармане связывания антагониста индольное кольцо W2696.48 перпендикулярно плоскости мембраны и в кармане связывания агониста S1P оно переворачивается на TM5 примерно на 70 градусов, а в рецепторной структуре, связанной с FTY720-P и BAF312, боковая цепь W2696.48 находится в промежуточной конформации структуры связывания S1P и антагонистом. Это показывает, что направление индольного кольца W2696.48 может использовать в качестве сенсора для смещенных β-аррестином лигандов. Сочетание функционального анализа и анализа молекулярно-динамического моделирования показало, что смещенные β-аррестином лиганды с помощью их различных структур изменяют режим распознавания лиганда S1PR1 , вызывая обширные взаимодействия между мотивами рецептора PIF и NPxxY и активируя различные сигнальные пути ниже по течению S1PR1, среди них промежуточный переворот W2696.48 и взаимодействие между F2656.44 и N3077.49 являются основными признаками активированных рецепторов, смещенной β-аррестином. Кроме того, результаты исследования также показали, что L2766.55 и L2977.39 в S1PR1 являются ключевыми сайтами для S1PR1, чтобы специфически распознавать BAF312. Это исследование обеспечивает теоретическую основу для разработки новых эффективных и безопасных препаратов , смещенных β-аррестином, и препаратов, селективных по подтипу рецепторов.
Эта проблематика является совместным проектом Центра наук о жизнедеятельности ХПУ и Университета Тохоку в Японии. Докторант Сюй Чжэньмэй из исследовательской группы Хэ Юаньчжэна ХПУ и докторант Тацуя Икута (Tatsuya Ikuta) из отделения фармакологии института аспирантуры Университета Тохоку являются первыми авторами. Докторанты Цянь Юй и Ся Жуйсюэ из исследовательской группы Хэ Юаньчжэн участвовали в исследовательской работе по этой проблематике. Старший инженер Го Чанъю и инженер Чжан Анци из общественной платформы Центра наук о жизнедеятельности ХПУ совместно участвовали в сборе структурных данных. Профессор-исследователь Хэ Юаньчжэн и профессор Иноуэ Аска из отделения фармакологии института аспирантуры Университета Тохоку, Япония, являются соавторами-корреспондентами.
Ссылка на источник:https://www.nature.com/articles/s41589-021-00930-3
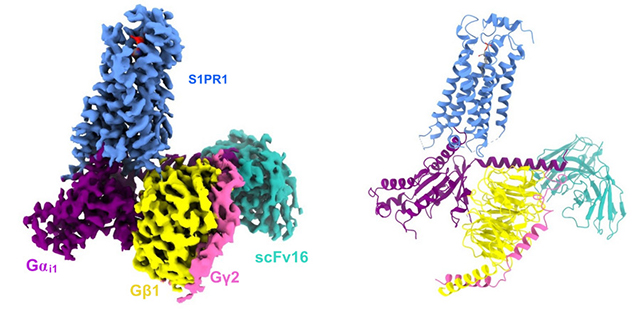
структура криоэлектронной микроскопии белкового комплекса S1PR1 / G
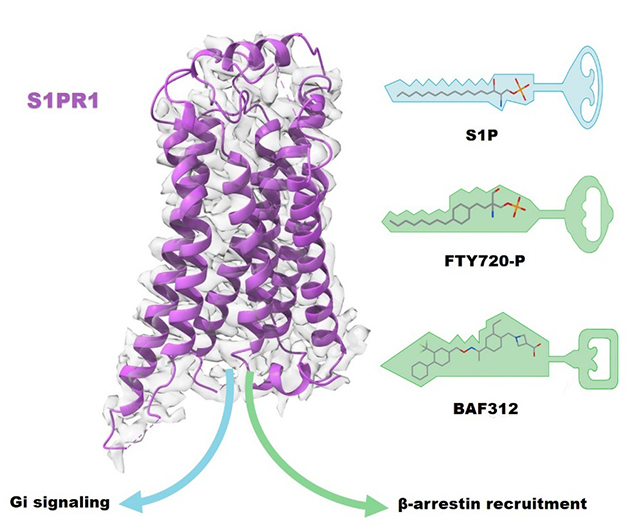
Структура S1PR1 раскрывает молекулярный механизм современных препаратов для лечения рассеянного склероза.

